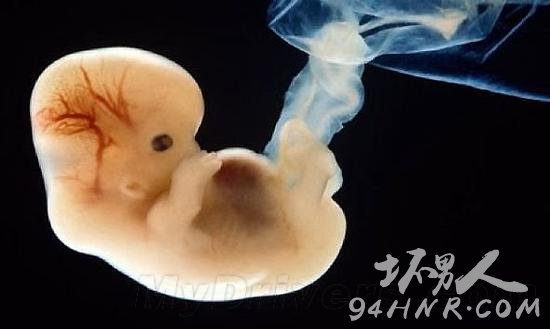
今年四月,中山大学生命科学院黄军就副教授修改了人类胚胎中导致β型地中海贫血的基因,作为世界首例人类胚胎基因修改,这项实验成果引发了极大争论——既然可以对基因进行选择和编辑,那未来我们能否完全摆脱遗传疾病,甚至从根源上“设计”婴儿?这一系列干预生殖背后,伦理问题又该如何解决?
修改“地贫”基因 科研成果引争议
近日,国际著名科学杂志《自然》的网站称,中山大学生物科学院的黄军就副教授及其团队完成了全球第一次在人类胚胎进行的基因修改实验,他们从医院获得了86个无法发育成婴儿的问题胚胎,并对当中与地中海贫血症有关的基因细胞进行基因编辑实验,利用一种叫做CRISPR/Cas9的工具成功修改了28个胚胎的基因。也就是说,如果此次基因改造技术成功,人类则有望从预防阶段彻底解决地中海贫血症。这一消息旋即引发了国内外媒体和科学界的广泛关注。
大部分科学家支持的观点是,从理论上说,基因改造技术可以用来帮助遗传病患者,让他们及其后代都摆脱家族性疾病的梦魇;但是从本质上说,这种实验是对人类生殖过程进行基因操纵。在英、德等欧洲国家,类似的研究是被法律禁止的,在美国,只能在严格的管制下用非联邦的经费进行。
对此,复旦大学生命科学院的赵世明教授也表达了他的担忧:“编辑基因有其限制和风险,虽然基因编辑实验是定向的,但改变基因序列可能会导致意外问题,这种问题也许会从上一代传到下一代,引发其他缺陷或疾病。”黄军就副教授的研究报告也提到,在实验后期的处理环节中,他们发现胚胎中有一些变异。
此外,基因实验还涉及成功率的问题,黄军就的团队用了86个废弃胚胎做实验,最后,DNA编辑只在其中28个胚胎中成功,成功率只有大约30%。“如果要对正常人类胚胎进行临床实验,成功率必须接近100%,可见这项研究还不够成熟。”黄军就副教授说。
地中海贫血症
在我国南方,地中海贫血症(简称“地贫”)是儿童中最常见、但可能致命的血液异常疾病。地贫以β和α型较为常见,输血治疗是常见疗法,但仅适用于中间型β和α地贫。对于重型β地贫,造血干细胞移植是目前可行的根治方法,如果手术成功,可以消除患者对输血的依赖,消除进一步铁过剩的影响,但不会逆转已存在的铁毒性,也不能防止将地贫遗传给下一代。所以,无论是输血还是造血干细胞移植,都不能一劳永逸地解决地中海贫血症。
“设计婴儿”:胚胎植入前诊断
既然基因修改技术尚不能用于临床,在对抗疾病、优生优育方面,目前现代医学采取了基因选择技术。1988年,伦敦哈姆斯密医院的医生首创了植入前遗传学诊断技术(简称“PGD”,又名“第三代试管婴儿”)。利用这种诊断技术,医生可以“设计”出一个不带遗传性疾病基因的婴儿,从根源上规避遗传性疾病。
PGD的第一步是进行试管受精,然后医生可以测试胚胎,选择健康的、不携带缺陷基因的胚胎植入母体。全球第一个“无癌宝宝”出生,应用的就是PGD技术:在母亲服用排卵药物后,一共有11个卵细胞在她体外受精,接着它们在试管里开始发育,等到成长至有8个细胞那么大的时候,基因选择就开始了——医生们小心地从它们体内抽取一个完整的细胞,进行基因测试。
结果,有6个胚胎遗传了父亲癌变基因,它们的人生还没有开始,就被宣告结束了。医生从剩余的5个胚胎中挑选获胜者。其中的两个幸运地进入了母亲的子宫,有一个顺利存活下来。而遵从父母的意愿,还有两个胚胎被冷冻起来,以备今后能为自己的孩子再添个弟弟或者妹妹。